海德堡大学《Adv. Healthcare Mater》:基于3D打印的可变形支架经过热解后,可用于肌肉细胞的三维培养
发布日期:2024-07-22
浏览量:546次
增材制造,通常被称为3D打印,在组织工程领域因其能够制造具有复杂三维和可定制几何形状的合成生物相容性支架而受到了显著关注。这些支架能够有效地支持细胞生长和组织形成,其中材料挤出、材料喷射和槽式光聚合在内的3D打印技术已被用于支架的制造。目前,生物打印技术可以直接3D打印细胞,这些细胞被嵌入水凝胶墨水中,能同时保持与解剖结构相似的空间布局。尽管增材制造在支架制造方面取得了快速进展,但仍存在一些挑战。尤其是在单个制造模式中实现部件大小、打印分辨率、尺寸范围、结构稳定性和生物相容性之间的最优平衡仍然难以实现。例如,最常用的基于注射器的制造方法(如熔融沉积建模和3D生物打印)在制造精度和分辨率方面仍不及其他增材制造技术。双光子聚合在制造精度和分辨率上达到了极高的水平,使得细胞水平上的支架交互成为可能,但它仍面临制造效率和构建体积的限制,通常构建体积小于1 mm3。相比之下,立体光刻和槽式聚合技术在扩大制造规模、提高精度和分辨率方面展现出潜力,但它们所采用的光固化环氧树脂作为打印材料,往往对细胞的生物相容性和毒性等方面都表现不佳。
碳,在生物材料支架和生物制造领域展现出巨大的潜力,这得益于其出色的生物相容性、化学稳定性以及可调节的机械和电气特性。在不同的碳同素异形体中,碳纳米管(CNTs)和石墨烯已经成为了非聚合物组织工程支架材料中的热门选择,这些材料中还展示了骨骼肌细胞的培养的可能性。然而,由于CNTs和石墨烯的纳米材料性质,这些材料不能直接进行增材制造。传统的3D碳材料结构化方法涉及使用基于模板的方法,可在3D多孔模板上生长或沉积碳纳米材料,然后通过腐蚀去除模板材料。这种方法的缺点是3D碳材料的形状受到支架材料特性的限制。作为替代方案,CNTs和石墨烯可以被整合到聚合物基质中以促进直接3D打印。然而,聚合物复合材料可能会损害原始石墨烯或CNTs的固有生物响应。
此外,将石墨烯或CNTs整合到聚合物基质中主要应用于基于挤出的3D打印,如前所述,这种方法在打印精度和分辨率方面存在不足,通常限制了细胞3D定殖。为了实现与所需组织工程应用相匹配的结构分辨率的3D打印纯碳,结构化聚合物前体的热解提供了一种可行的解决方案。通过结合不同的增材制造过程和后续的热解过程,已经证明在不同的长度尺度上可以实现3D结构化热解碳(PyC)的可行性。例如,双光子聚合可以制造出具有分辨率高达数百纳米的3D结构的PyC。相比之下,立体光刻3D打印的结构尺寸可以从亚100微米到几毫米。然而,将3D结构的PyC作为细胞3D生长支架的应用仍未被探索。一些研究表明,在骨骼组织工程中使用3D结构的PyC结构具有前景。然而,这些研究中的孔隙大小(>300 μm)在元素之间显著较大,仍然限制了实现细胞3D定殖。
基于此,来自海德堡大学的研发团队设计了一种可变形3D结构的PyC作为潜在的生物材料支架,并研究了它们与骨骼肌细胞的相互作用,以实现细胞的三维培养。该研究以“Microarchitected Compliant Scaffolds of Pyrolytic Carbon for 3D Muscle Cell Growth”发布在国际期刊《Advanced Healthcare Materials》。
在本研究中,团队使用摩方精密面投影微立体光刻(PμSL)3D打印技术(nanoArch® S130,精度:2 μm)制备出主要结构,随后通过热解实现了具有与骨骼肌细胞相当可变形PyC支架的尺寸特征。尽管在组织工程应用中通常使用固定的刚性支架,该研究团队还将开发一种新颖的概念,用于制造可变形的PyC支架。在这里,“形状变形”指的是结构通过机械或手动操作改变其空间排列的能力。需要注意的是,PyC本质上具有脆性,限制了其自然形状变形的潜力。为了克服这一挑战,团队采用了基于可变形机制设计的方法,以实现PyC结构的可变形能力。
PyC结构热解过程由于前驱体树脂的热化学分解释放气态化合物而导致显著的几何收缩。这种收缩使得PyC晶格厚度可以明显小于制造能力,例如,设计晶格厚度为15微米的结构在热解后PyC晶格厚度为4.1 ± 0.4 μm。收缩程度取决于前驱体的晶格厚度和热解温度。气态副产物的释放通过从表面排气,因此,较高的表面积导致较高的排气程度。较小的晶格厚度提供了较高的表面积与体积比,导致较高的收缩程度,例如,当最终热解温度为900°C,设计晶格厚度从15到150 μm的收缩率为73 ± 3%到60 ± 2%。另一方面,将热解温度从500°C增加到900°C,对于150 μm的晶格厚度,收缩程度从50 ± 3%增加到60 ± 2%。收缩的温度依赖性主要归因于温度范围内的质量损失。
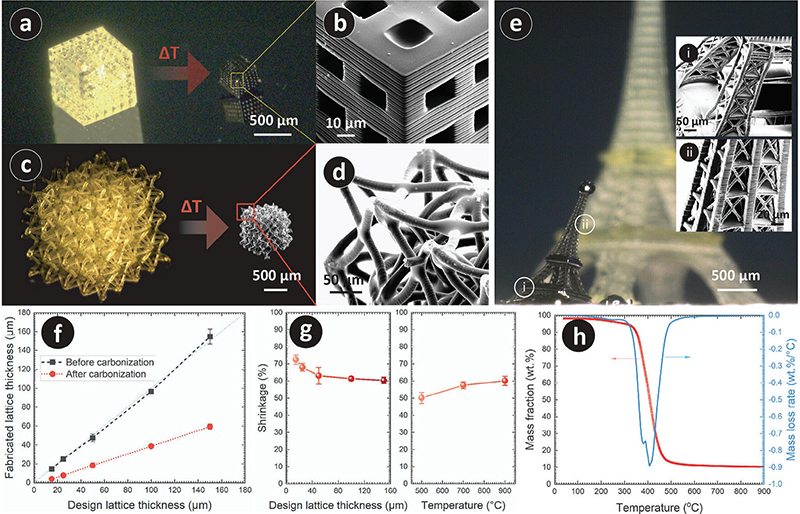
图1. 3D打印的具有立方单元晶格的架构,碳化前后的对比。
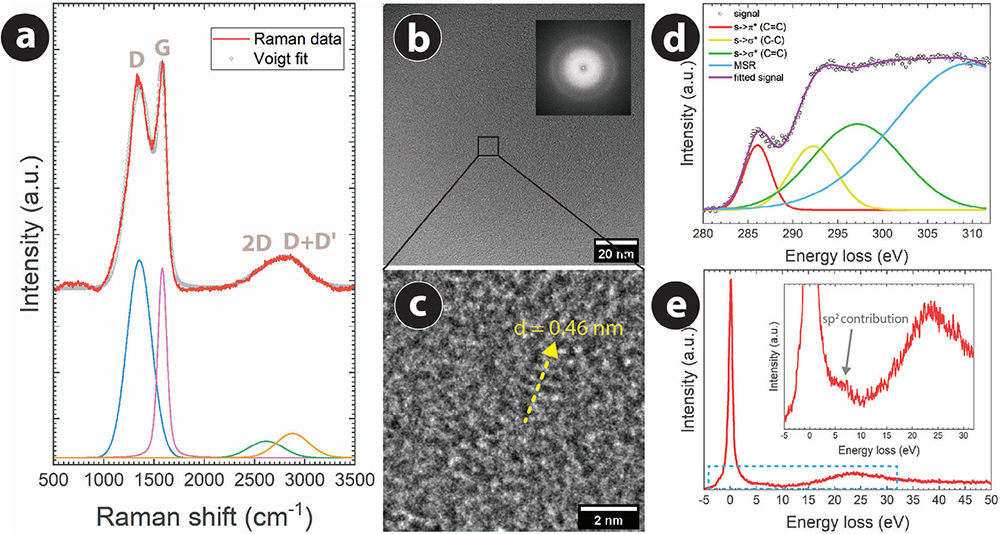
图2. 在900°C碳化温度下制造的3D结构PyC的Raman光谱。
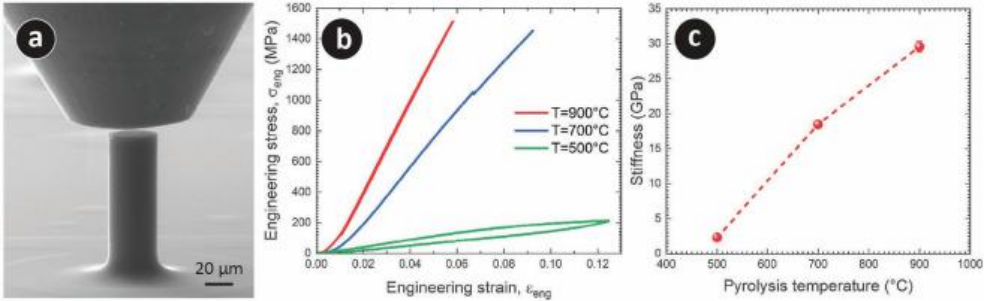
图3. 用于微机械测试的3D PyC微柱。
热解碳本质上是刚性和脆性的。由于其固有的刚性,改变PyC材料的几何形状极具挑战性,几乎是不可能的。为了解决这一挑战,团队采用了基于可变形机制设计的方法。设计了具有铰链的几何结构,其中单元通过涉及环形环和轴的控制间隙的旋转关节连接,从而具有可变形特性,并通过这些旋转关节实现形状变化的能力。

图4. 通过旋转关节设计实现的3D打印可变形结构。
然后,研究团队在3D打印热解后的PyC支架中培养了C2C12细胞,以评估其生物相容性和细胞生长的能力。C2C12细胞通常被用作肌肉研究的模型细胞,因为它们具有单核和梭形的成肌细胞,这些细胞后来分化为多核的肌管,模仿体内肌肉纤维的形成过程。通过甲基噻唑蓝溴化物(MTT)代谢活性和细胞间接接触PyC材料的活死染色,团队检查了PyC支架的生物相容性,图5b显示了500°C、700°C和900°C的PyC结构使用MTT试验的结果,表明所有结构都是生物相容的。团队还对骨骼肌细胞间接接触结构进行了活死染色,以进一步研究PyC材料的生物相容性。用钙黄绿素/碘化丙啶染色后,测量了活细胞与死细胞的比率,并绘制在图5a中,用于不同热解温度获得的PyC支架,在结构上并没有看到对肌肉细胞的毒性迹象。
肌动蛋白纤维显著影响细胞内的运动能力、细胞附着和机械性能。因此,团队研究了C2C12细胞在碳格上的细胞骨架排列。图5c–h中phalloidin的荧光图像揭示了细胞骨架中密集的丝状肌动蛋白束。细胞主要覆盖了结构的边缘。培养的细胞中的肌动蛋白纤维似乎在细胞骨架中随机分布。有趣的是,经过七天的培养,孔隙中至少填充了43 μm深的骨骼肌细胞,这表明实现了3D定殖,这对于许多组织工程应用是至关重要的。细胞3D定殖进一步通过SEM调查得到证实。图5i–k展示了经过22天细胞培养的生物混合构建的SEM图像。细胞完全覆盖了PyC支架,并表现出延长的形态,这表明细胞在PyC表面上的优先生长。此外,观察到细胞在孔隙中生长,并在孔隙上桥接,表明PyC支架支持3D骨骼肌细胞生长。

图5. 3D结构的PyC支架的生物相容性。
骨骼肌细胞支架的关键标准之一是它们诱导成肌管形成的能力,成肌管是由成肌母细胞融合产生的多核纤维结构。 因此,团队通过分析Hoechst和phalloidin染色的细胞核和肌动蛋白纤维的荧光,研究了PyC支架诱导成肌管形成的能力。图6展示了在不同热解温度下制备的PyC支架上形成非常少的成肌管。此外,团队还在PyC支架上进行了荧光研究,以研究形成的肌动蛋白。这些结果表明,在不同温度下PyC支架上都形成了成肌管,并且它们在支架表面很好地发育并随机定向。
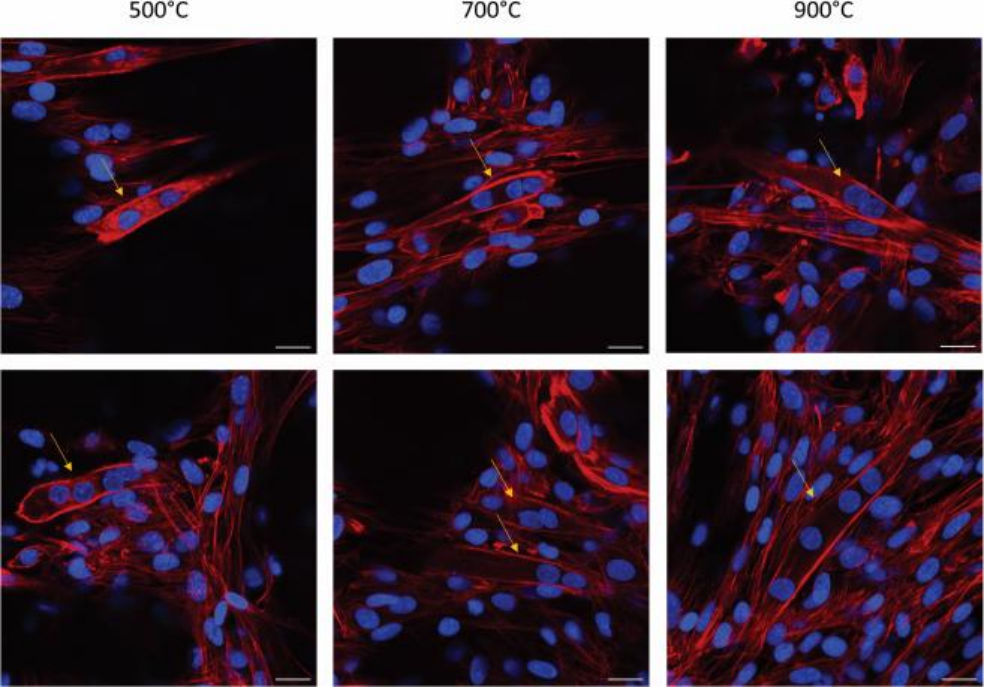
图6. 荧光图像显示了在500°C、700°C和900°C热解3D结构的PyC上的C2C12细胞。
在3D支架中,细胞迁移和增殖,向内延伸以最终封闭或桥接孔隙,形成类似组织的片状结构。细胞的集体行为,包括在3D结构中传播时的速度和最终形状的桥,取决于孔隙的几何形状和大小。例如,在发展的界面上细胞拥挤或展开取决于初始基质是凹的还是凸的。为了更广泛地探索C2C12细胞与可变形的PyC结构之间的相互作用,细胞被培养在PyC链结构上,这些结构为3D细胞生长提供了各种几何形状。通过实验可以看到,细胞覆盖了整个链结构,包括格构件之间的间隙甚至旋转关节内。细胞被观察到以平坦的片状而不是聚集体的方式排列,在这些片状中形成了多个细胞层。随后,它们利用细胞间连接桥接孔隙,跨越相当大的距离并有效地填充孔隙。
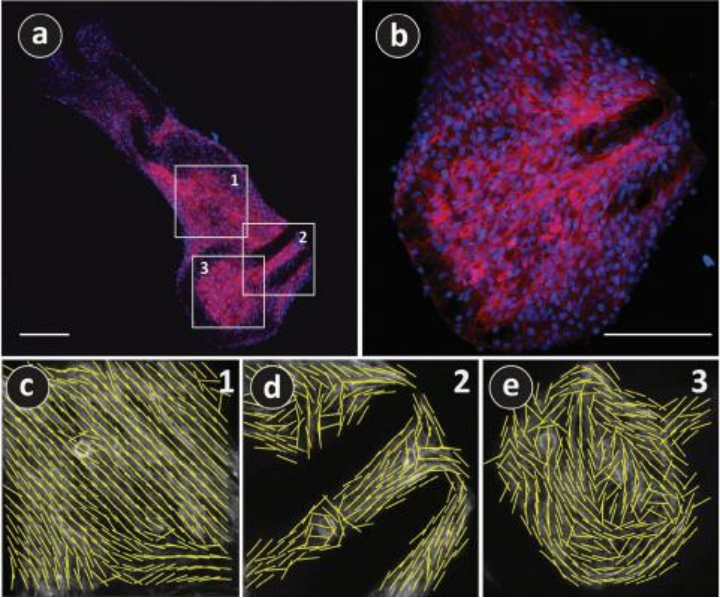
图7. 热解后PyC链结构上的C2C12细胞的低倍和高倍荧光图像。
综上,研究团队首次展示了微型结构热解后的碳结构用于骨骼肌细胞的3D细胞生长。团队通过利用摩方精密PμSL技术制造树脂微型结构,然后进行热解得到3D结构的PyC。除了典型的固定和刚性的3D结构的PyC外,团队还采用了一种新的设计方法制造了新的可变形3D结构的Pyc。在细胞培养过程中,C2C12骨骼肌细胞表现出对PyC材料的强烈亲和力,显示出良好的生物相容性和细胞增殖。细胞在刚性和可变形的PyC支架中定殖,行成真正的3D细胞定殖。3D结构的PyC进一步导致培养的肌肉细胞中的肌动蛋白纤维沿可变形结构的良好排列。在PyC结构表面也形成了大量成肌管,其形成依赖于与热解温度相关的PyC刚度。然而,PyC材料的成肌分化能力在这里并未完全实现,这需要进一步的广泛研究。
本研究的结果对于利用3D打印的热解碳结构作为细胞支架具有重要意义,3D结构的PyC对细胞的亲和力可能为多功能支架的设计提供新的视角。
原文链接:
https://doi.org/10.1002/adhm.202303485











