港中文张立/哈工大(深圳)金东东《Sci.Adv.》:微纳3D打印制备多功能模块化微型机器人,用于胆管内靶向细胞递送
发布日期:2024-01-10
浏览量:943次
微型机器人是一种尺度在毫米及以下,能够将外界能量转化成主动运动的微小型器件。基于其尺寸小、运动主动、灵活度高的特点,微型机器人能够深入常规医疗手段难以触及的狭小闭塞区域,有望作为一种新型的医疗工具,展现出巨大的应用潜力。在已开发的微型机器人中,磁控微型机器人因其能量来源(即外加磁场)易调制、对生物组织穿透性强且无危害,在许多生物医学领域尤其是细胞靶向递送方面受到了广泛关注。
研究者们通过微纳制造或化学合成,再辅以表面蒸镀磁性薄膜或内部掺杂磁性颗粒,构建了各式可响应外部磁场的微型机器人。作为细胞的载具,微型机器人能够主动地将细胞精确递送至目标区域,从而解决传统细胞递送策略靶向性差、效率低的痛点。但是,这类微型机器人的细胞功能和磁控功能存在一个不容忽视的矛盾,即为了追求强磁控能力添加大量磁性材料,这样使得微型机器人的细胞活性就会衰退,且严重影响细胞的黏附、释放和分化行为,甚至还可能因在体内滞留或降解而引起生物毒性。但若为了优化细胞功能而降低磁性物质含量,微型机器人就可能难以在复杂动态的生物环境内进行有效的驱动导航。因此,如何解决细胞功能和磁控功能的兼容性难题,对细胞递送微型机器人具有十分重要的研究意义。
近期,香港中文大学的张立教授课题组和哈尔滨工业大学(深圳)的金东东副教授共同提出了一种微型机器人的多功能模块化设计策略(图1),解决了其驱动性能和细胞活性无法兼容的难题,并成功用于胆管内干细胞的靶向递送。该机器人由微纳3D打印制备的磁场驱动(MA)模块和细胞支架(CS)模块组成,前者具有强磁性和pH响应变化形状的能力,后者细胞亲和力好,能够负载与释放细胞。作者团队首先将MA模块浸泡在酸性缓冲液中使其收缩,然后将MA模块插入CS模块并将缓冲液调制中性,之后MA模块膨胀并与CS模块机械互锁,便成功构建了模块化机器人。通过采用前端介入递送-后端磁控导航的多级递送策略,作者团队成功将微型机器人快速递送至目标病灶,并在急性/慢性胆囊炎、胆道炎和胆管堵塞等疾病引发的局部较低pH值的作用下,使得MA模块收缩,并与CS模块拆卸分离。最后,CS模块可在胆汁的作用下逐步降解释放细胞治疗病灶,而MA模块则磁控驱动至导管处被回收。
综上,该方案有效解决了以往细胞递送微型机器人面临的问题,同时兼顾了磁控功能和细胞功能,因此以“Modularized microrobot with lock-and-detachable modules for targeted cell delivery in bile duct”为题发表于《Science Advances》期刊(Sci. Adv. 2023, 9, eadj0883)。文章第一作者是香港中文大学博士生苏琳和哈工大(深圳)金东东副教授,文章通讯作者是金东东副教授,香港中文大学张立教授和陈启枫研究助理教授。

图1. 3D微纳打印模块化微型机器人及其在干细胞靶向递送的应用
为了实现模块化微型机器人的按需组装与拆卸,MA和CS模块的材料设计与制造技术至关重要。为此,作者团队分别合成了两种水凝胶打印树脂,并采用高精度面投影微立体光刻(PµSL)技术微纳3D打印机(摩方精密nanoArch®S130,精度:2μm)制备了两种模块(图2)。MA模块的打印树脂主要由pH响应型功能单体(甲基)丙烯酸(M)AAc,功能调试单体N-异丙基丙烯酰胺NIPAAm,和交联剂乙氧化三羟甲基丙烷三丙烯酸酯(TMP6EOTA)组成。其光固化成型后在酸性环境收缩,碱性环境膨胀,而临界转变pH值可通过控制(M)AAc和NIPAAm的比例进行调节。此外,树脂中还添加了适量增稠剂聚乙烯吡咯烷酮以调节粘度,将适量平均尺寸5-10微米的磁性颗粒稳定分散持续超过24h,使得磁性颗粒质量分数高达50%,这为制备磁响应能力强的MA模块提供了保障。CS模块的打印树脂则由可降解生物材料甲基丙烯酸酯化明胶(GelMA)和用于调节机械强度的丙烯酰胺(AAm)组成,其光固化成型后生物相容性好,细胞亲和力强,可有效负载大量细胞,并且能够在胆汁中存在的消化酶的作用下逐步降解,从而释放细胞。
MA模块和CS模块均可通过使用摩方精密的微纳3D打印技术制备,该技术不但加工精度高(在掺杂磁性颗粒的条件下分辨率仍达20微米以上),加工效率也令人满意(图3和图4)。通过精巧地设计MA和CS模块的相对尺寸,并进一步调控环境pH值和施加外界磁场,两种模块可以实现稳定的机械互锁(图5),也可以在粘性流动的环境中完成按需的快速拆卸,这为模块化微型机器人靶向递送细胞奠定了基础。

图2. 微型机器人微纳3D打印和各个模块的高精度打印效果
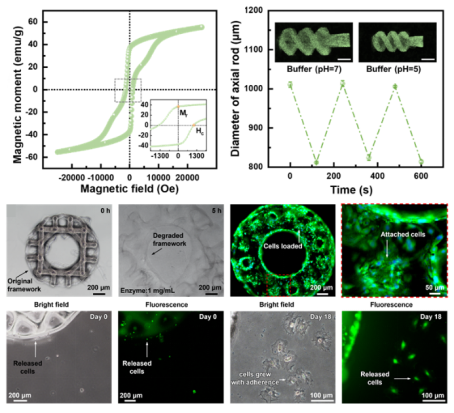
图3. MA模块的强磁性和环境响应能力,与CS模块的细胞复杂和释放能力
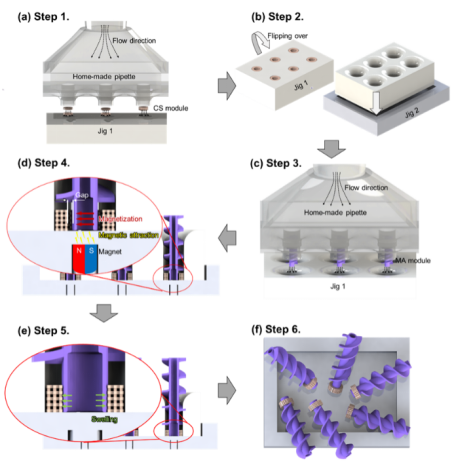
图4. 多个模块化微型机器人的批量化组装示意图
之后作者团队在胆管模型中展示了模块化微型机器人介入递送-磁控导航-按需拆卸-释放CS模块-回收MA模块的全部流程,显示了模块化微型机器人可实现高效、安全的靶向细胞递送。最后,作者团队在离体猪胆管和活体新西兰白兔体内进一步验证了靶向递送的可行性,且全程可由X射线和超声成像实时观测(图5)。综上,这项工作有力地促进了生物医用多功能微型机器人的发展,为其今后走向实际应用提供重要参考。
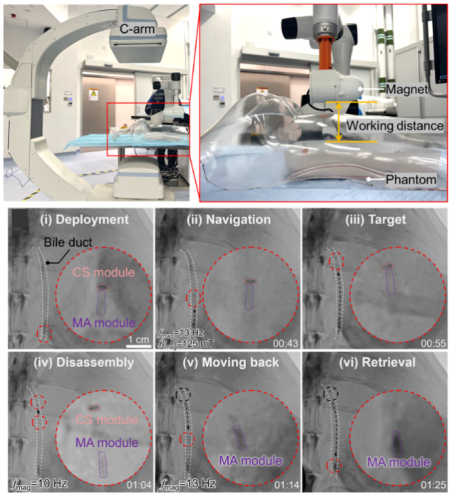
图5. 模块化微型机器人的驱动与成像装置,及其在活体兔子体内的递送与回收
原文链接:
https://doi.org/10.1126/sciadv.adj0883











