3d打印CIF微流控平台|美国圣母大学《ACS Nano》:用于细胞外纳米载体的可扩展高通量等电位分离平台:从血浆、尿液和唾液中全面无偏差地分离核糖核蛋白
发布日期:2024-07-01
浏览量:546次
微流控 ( microfluidics ) 是一种以在微纳米尺度空间中对流体进行精确操控为主要特征的科学技术,具有将生物、化学等实验室的基本功能诸如样品制备、反应、分离和检测等微缩到一个几平方厘米芯片上的能力,其基本特征和最大优势是多种单元技术在整体可控的微小平台上灵活组合、规模集成。该技术通过对流量的控制,实现化学分析、药物筛选、细胞培养、基因检测等多种功能,在时间和空间上为实验机构研究分子浓度控制带来了全新的技术解决方案。
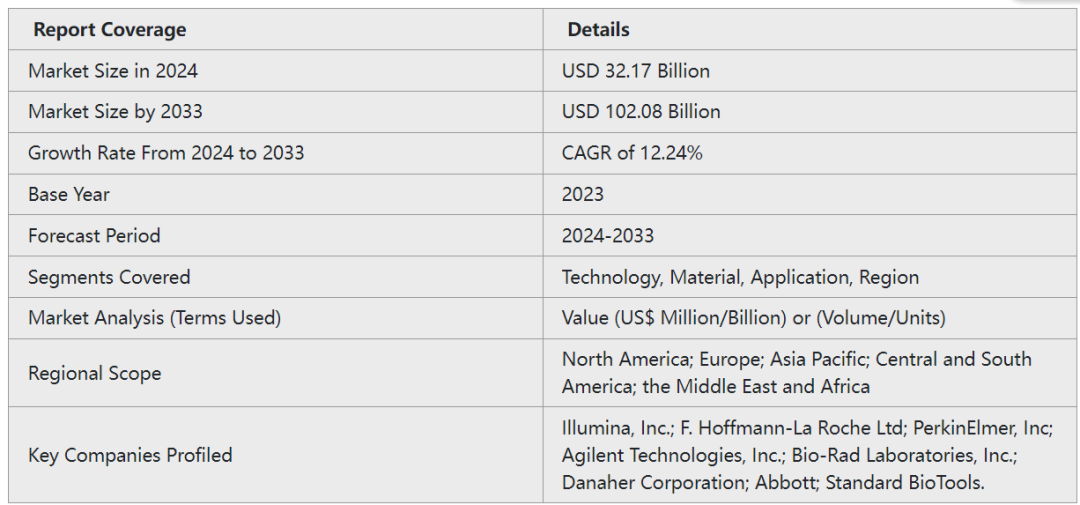
微流控的两项主要应用为POCT和生物制药科研(包括测序、基因组学和蛋白质组学)。根据Nova One Advisor报告,2023年全球微流控产品市场规模达到321.7亿美元,2024至2033年期间的年复合增长率可达12.24%,预计2033年将达到1020.8亿美元。同时,微流控设备的市场规模在2024~2033年,年复合增长率为12.56%。可以预见,微流控芯片技术将在生物医药的科研与实际应用中发挥巨大作用。
现阶段,微流控技术主要应用在即时检验和生物制药、生命科学研究等领域。随着微纳3D打印技术的迭代发展,其可快速将模型数据形成实物,具有简化步骤,缩短论证时间和开发周期等优势,为微流控技术研发提供了更广阔的创新空间。
细胞外纳米载体(包括细胞外囊泡(EVs)、脂蛋白和核糖核酸蛋白)在蛋白质和核酸的细胞间通讯中发挥媒介作用,并且作为独特的循环生物标志物在临床上具有适用性。然而,由于纳米载体在大小和密度上的重叠,使得迄今为止难以有效地进行物理分离,这进而阻碍了对下游分子的分析。
基于此,来自美国圣母大学的Hsueh-Chia Chang教授团队研发了一种无偏差、高通量和高产量的连续等电位分离纳米载体分离技术。该技术基于它们独特的等电点。这个纳米载体分离平台通过在双极膜上进行水的分解提供了一个强大且可调节的线性pH剖面,并通过流动稳定化,而无需使用两性电解质。
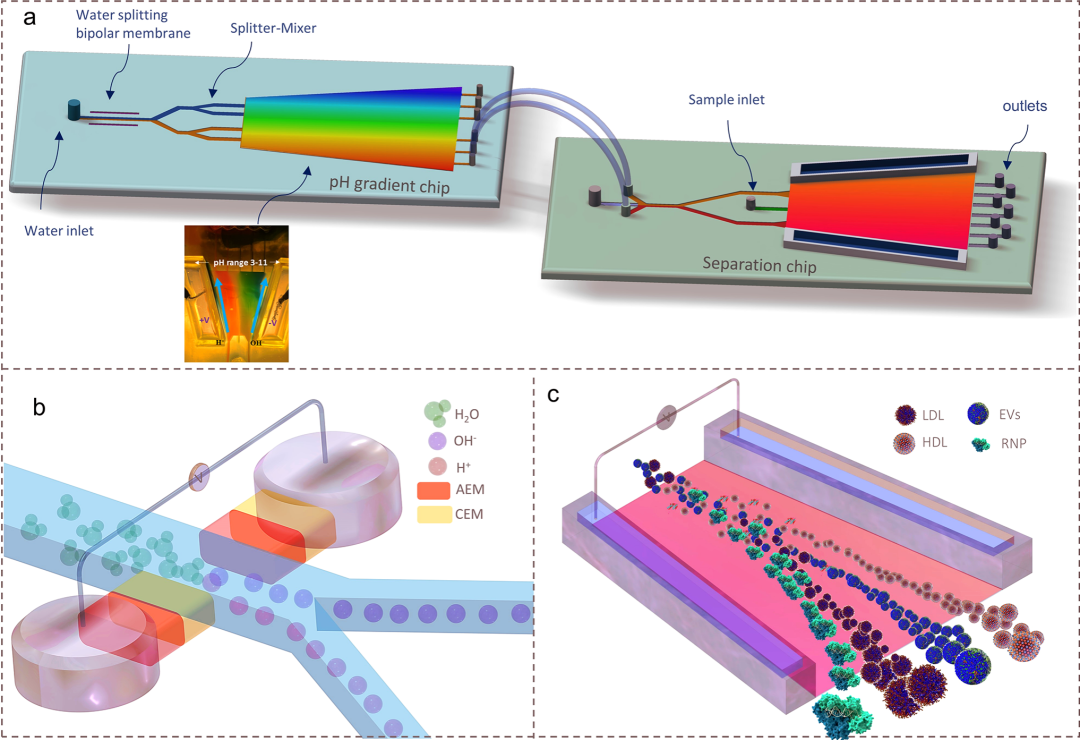
图1. CIF微流控芯片的设计和操作。
虽然研究团队已经针对关键纳米载体在干扰缓冲液中校准了pH流出范围,但纳米载体的等电点可能在血浆和其他生理液体中发生变化。为了考虑等电点的变化并实现精细分离,需要进行繁琐的调整,从pH梯度芯片中选择所需的pH范围,然后进行视觉检查和与pH参考表的比较。
为了减少驱动的偏差并提高设备重复性,研究团队开发了一种自动CIF分析器。这是一种利用机器学习的平台,能够实现自动化的pH检测,可以针对不同的生理流体和纳米载体进行重新校准。该分析器的工作流程由两个主要模块组成:图像分割模块和pH检测模块。图像分割模块通过机器学习技术来识别ROI,而pH检测模块则通过应用专门开发的校准曲线,为ROI内的每个像素分配pH值,从而创建出ROI的空间pH分布图。
研究团队采用摩方精密面投影微立体光刻(PμSL)高精度3D打印技术制作出CIF微流控平台。优化后的技术具有0.3 ΔpI的分辨率,足以分离所有纳米载体甚至纳米载体的亚类。然后使用包括血浆、尿液和唾液样本在内的几种生物流体对其性能进行评估。在30分钟内,从各种生物流体的0.75 mL样本中实现了全面、高纯度(血浆:>93%,尿液:>95%和唾液:>97%)、高产率(血浆:>78%,尿液:>87%和唾液:>96%)和无探针的核糖核酸蛋白分离,明显超越了那些产量较低且需要较长时间的高偏差黄金标准。EVs和不同脂蛋白的二元分离也实现了类似的性能。
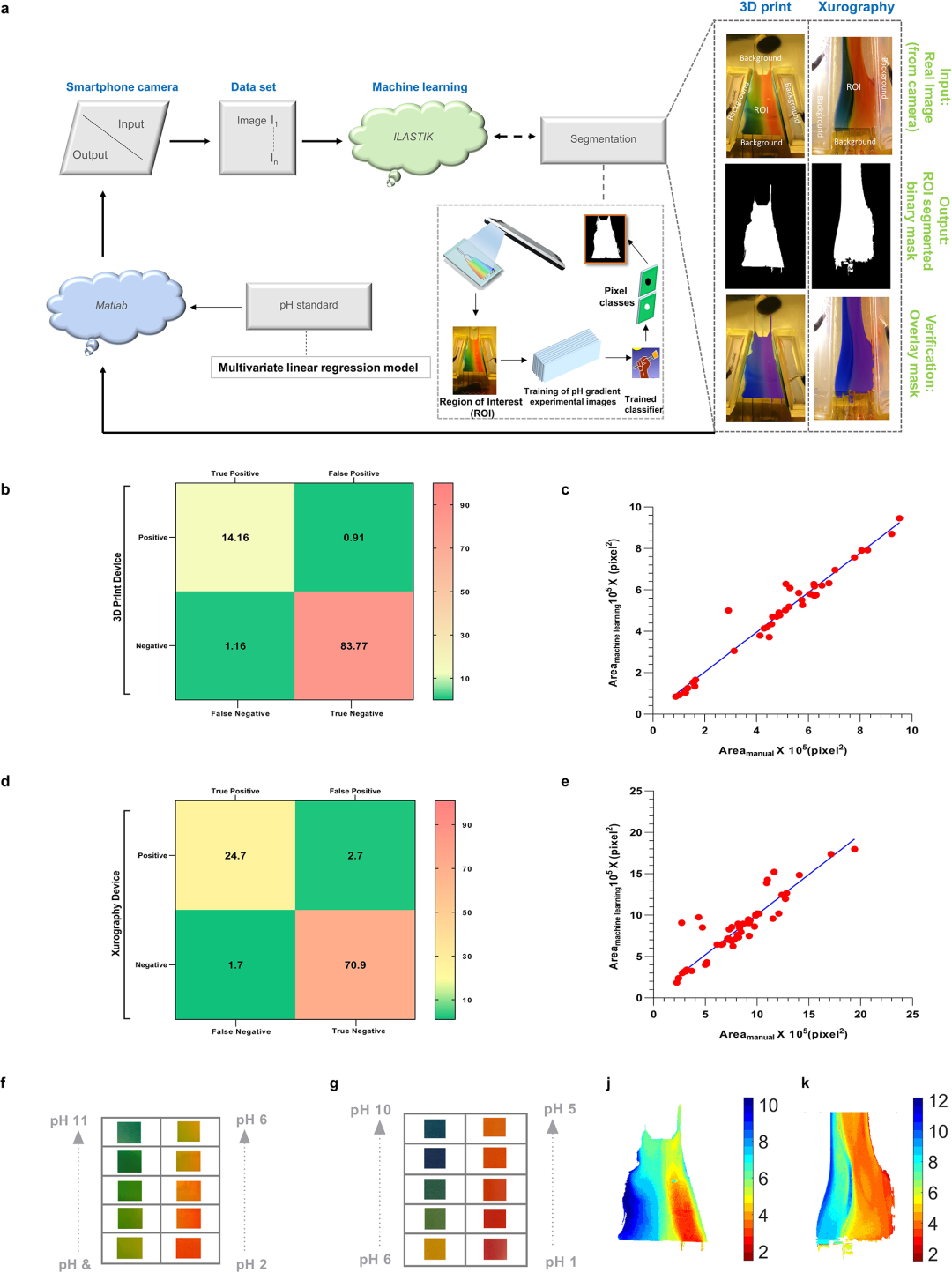
图2. 基于机器学习的自动CIF分析器,用于提高pH判断和实验可调性。
该研究为利用3D打印微流控芯片进行疾病监控提供了全新视角。该研究工作以“A Scalable High-Throughput Isoelectric Fractionation Platform for Extracellular Nanocarriers: Comprehensive and Bias-Free Isolation of Ribonucleoproteins from Plasma, Urine, and Saliva”为题,发表在国际著名期刊《ACS Nano》上。
论文链接:
https://doi.org/10.1021/acsnano.3c01340










