摩方微流控3D打印应用-墨尔本大学David J. Collins课题组《Small》:用于可拆卸微流体装置的微声全息图
发布日期:2024-07-15
浏览量:885次
微流控技术已经成为化学、纳米科学和生物医学领域的一个重要工具之一。相较于传统的实验室技术,微流控设备因其结构紧凑、制造成本低、响应速度快以及能够精确控制微环境等独特优势而受到青睐。为了在微流控系统中实现微米级别的精准操作,研究者们开发了多种技术手段,如微夹具、电润湿技术,以及磁光力和声学力等。在这些技术中,声学操控因其无需接触、良好的生物相容性以及对细胞尺度操控的能力而被广泛应用于微流控设备中。
在声学微流控设备中,声场通常形成压力场模式,包括节线/反节线位置,并用于翻译和图案化液滴、颗粒和细胞。这些声场可以生成线条、网格和与通道界面相符的衍射模式。然而,产生这些模式的声学方法在生成更复杂的声场或可重构性方面能力有限。虽然可以通过使用微流通道中的微结构通过声学-结构相互作用来捕获微颗粒来生成更复杂的模式,但这些方法需要在该通道内制造和引入额外的结构,并且只能用来创建固定的声场模式。然而,机器人辅助的声学流量控制已被证明具有多功能性,它能够在泵送、微颗粒捕获、液体混合和液滴合并等方面发挥作用。这种方法通过在多轴定向系统中生成可修改空间的毛细管末端微流来实现,尽管它最初是在微流控设备之外的环境中被开发的,但已经明确的是,在微流控平台上开发高分辨率、复杂且可配置的模式对于生物医学应用具有至关重要的意义。
基于此,来自墨尔本大学的David J. Collins课题组研发了一个可拆卸的微流控设备,该设备采用微型声学全息图来创建微流控通道中可重构、灵活和高分辨率的声学场,其中引入的固态耦合层使这些全息图易于制造和集成。该研究还展示了如何使用该方法在微流体通道内生成灵活的声场,包括形状、特征以及任意旋转的图案。该研究工作以“Micro-Acoustic Holograms for Detachable Microfluidic Devices”为题,发表在国际著名期刊《Small》上。
该研究展示了迄今为止最小的相位调节声学全息图,并利用它在非封闭微通道中产生了设计的声学场。为了实现这一目标,研究团队通过微全息图调制的声波穿过聚二甲基硅氧烷(PDMS)耦合层,进入微流控通道,从而形成了高分辨率的声学模式。其中微型全息图是由摩方精密高精度3D打印系统制备的。团队选择使用固态PDMS耦合层而非液态,是因为其易于集成的特性,可显著简化系统处理,并使得微全息图的耦合、分离和旋转变得简便,进而在流体通道中实现了可重构声学模式的生成。
通常,创建复杂声学模式会涉及到使用二进制声学全息图,因为它们的简单性使其易于通过传统的光刻工艺进行制造。但是,这种二进制声学全息图在信息容量上存在限制,这是由于它们基于声学振幅的二值化特性。由于在其他应用中常用的打印分辨率大约在0.1–1 mm,这限制了全息图的分辨率以及可应用的声学频率范围。为了克服这一限制,研究团队决定采用摩方精密面投影微立体光刻(PμSL)技术来制备相位微全息图,从而提高了全息图的分辨率并扩展了可应用的声学频率范围。
可拆卸微流控声学全息术是将可拆卸微流控通道和声学全息图相结合的技术,其中由聚二甲基硅氧烷(PDMS)制成的微流控通道通过PDMS耦合层与3D打印的全息图耦合(图1a)。入射声波从换能器沿+z方向传播进入全息图,并发生调制。传播穿过PDMS层后,目标声场在微流控通道中生成(图1b),其中生成的声场通过彩色PDMS微颗粒可视化(图1c,显示Collins生物微系统实验室的标志)。制造的全息微流控设备具有5 mm×5 mm的微流控领域(全息孔径),整体尺寸为13.5 mm×9.5 mm×2 mm,比1元澳币还要小(图1d)。
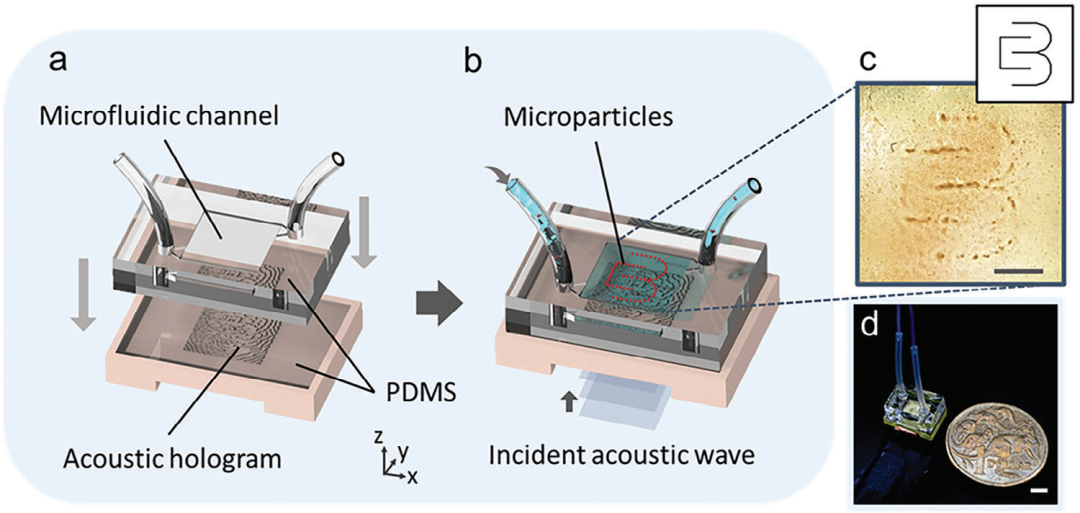
图1. 可拆卸微流体装置的声全息示意图。a) 可拆卸的微流体通道通过 PDMS 耦合层与声全息图耦合。b) 入射声波由全息图调制,然后穿过耦合层并在微流体通道中产生目标声学图案,这些图案由微粒可视化。c) Collins Biomicrosystems Lab 徽标的实验结果,其中插图显示输入图像。d) 制造可拆卸的全息微流体装置。比例尺为 1 毫米。
微流控通道设计为可轻松拆卸和重复使用,并可放置在与全息图成一定角度的位置。因此,可以在微流控通道中切换不同的声场模式,或者通过适当定位和旋转通道中的模式来实现声场的多样化。
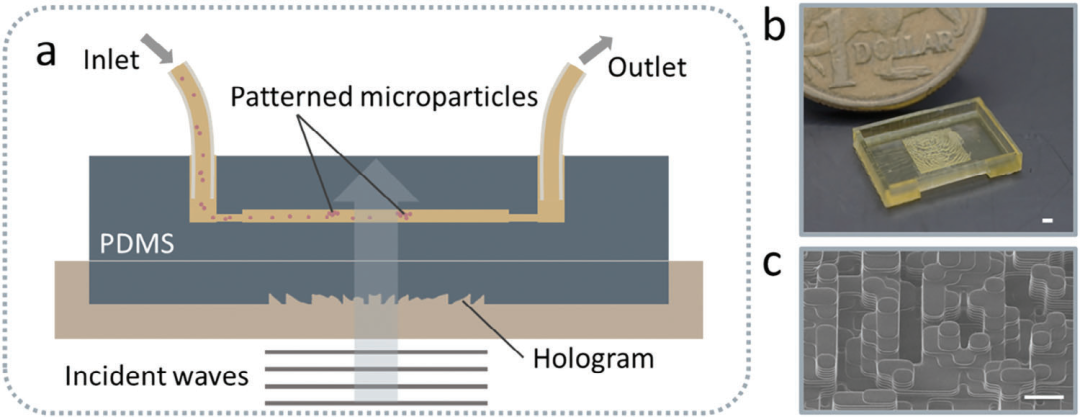
图2. 拆卸全息微流控装置的原理。a)由全息图调制的入射声波穿过PDMS耦合层并在微流体通道中产生声学图案,其中微粒通过声学力形成图案。b)没有PDMS耦合层的3D打印微全息图,全息图的孔径为5×5 mm。比例尺为 1 mm。c) 微全息图的氦离子显微镜图像。比例尺为 100 µm。
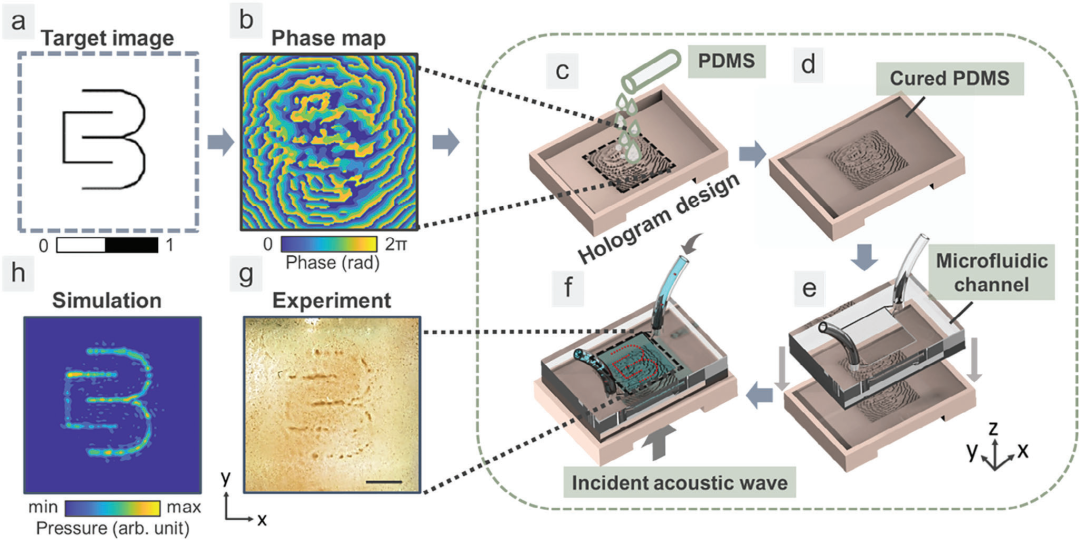
图3. 可分离的全息微流控设备的设计与实物。a) 实验室徽标的二值图像作为目标图像输入,并计算为b) 相位图。c) 包括相位信息的全息模型被3D打印并填充PDMS。d) PDMS固化后,e) 将微流控通道放置其上。f) 将微颗粒注入微流控通道,其中入射声波由全息图调制并穿过PDMS耦合层以图案化微颗粒。g) 实验图像显示,获得的微颗粒图案与h) 模拟结果相对应。
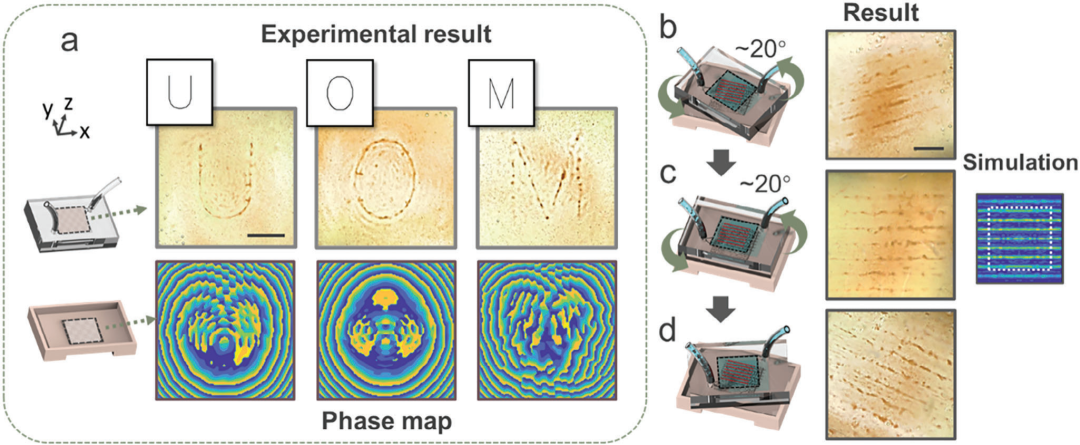
图4. 微流控设备中的全息图案生成,a) 字母“UoM”(代表墨尔本大学)。b–d) 旋转声学条纹,其中微流控通道和全息图可以倾斜以使用相同的全息图产生不同配置的声学场,刻度尺为1毫米。
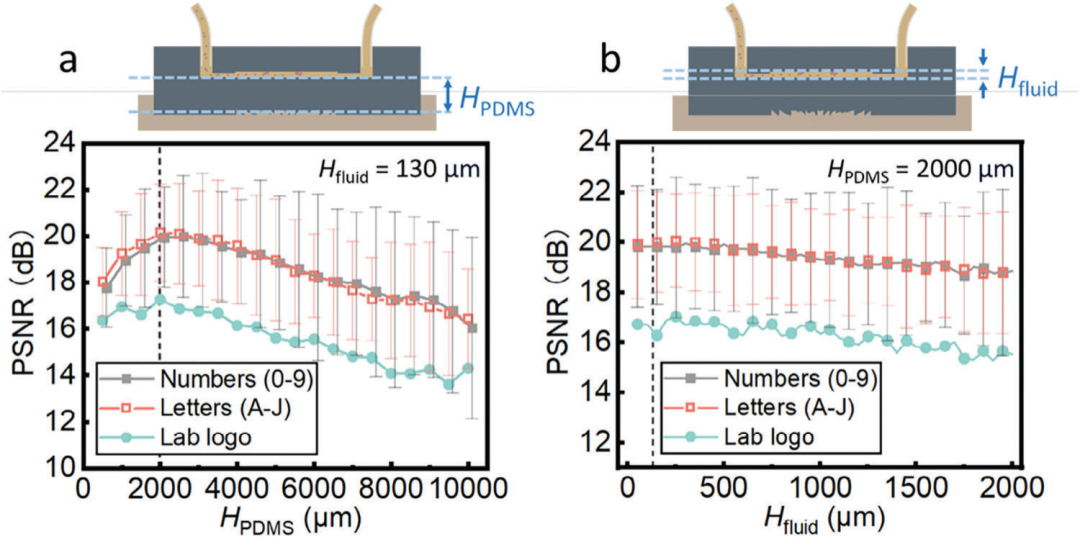
图5. 耦合层厚度(HPDMS)和流体域厚度(Hfluid)对图像质量的影响。a) Hfluid = 130 μm时HPDMS与PSNR的关系,其中PSNR表示图像质量。b) 改变Hfluid的结果,其中HPDMS = 2000 μm。
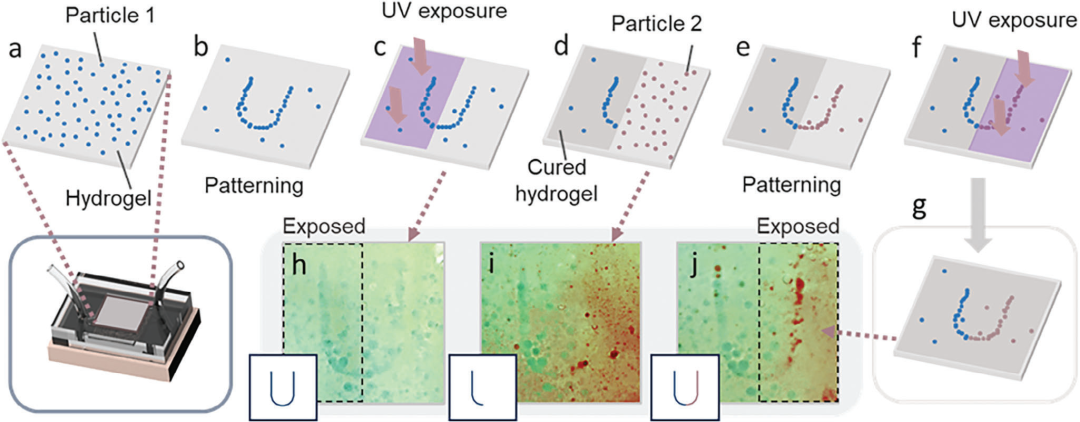
图6. 在水凝胶中模式化不同类型的颗粒。a) 含有蓝色颗粒的水凝胶(制备方法见实验部分)被注入微流控通道中,b) 使用全息声学场进行模式化。c) 通过UV曝光局部固化水凝胶。d) 含有绿色颗粒的水凝胶被注入未固化的区域。然后绿色颗粒被e)模式化和f)暴露。g) 含有不同类型颗粒的固化水凝胶。h–j) 分别对应于(c,d,g)的实验结果。实验使用蓝色和绿色PDMS颗粒进行,其中绿色颗粒被数字重新着色为红色以提高可视化效果。
声学全息术拥有生成定制声场的独特能力,先前的实验已经展示了其对粒子和组织细胞进行精确操控的能力,以用于制造工程化的组织和材料。然而,传统的声学全息术实现大多在开放的空气室或容器中进行,所生成的声学目标场尺寸通常仅能达到厘米级别。
本研究展示了基于微通道的致动生成声学全息图,从而发挥了封闭通道在液体处理和控制方面的优势。由于在之前的设置中采用了浸没式换能器,导致在不同声学全息图之间切换过程变得复杂。为了简化这一过程,研究团队开发了一种使用微声学全息图的可拆卸全息微流体设备。换能器耦合的声波通过3D打印的全息图进行调制,从而在微流体通道中生成高分辨率的声学模式。这些通道可以与微全息图进行耦合、拆卸和旋转,以实现可重构声学模式的生成。与使用液体耦合的声学全息图相比,采用固态PDMS耦合层代替的声学全息图,可使得与微流体通道的集成更为便捷。研究团队在微通道中展示了这一方法,能够生成线条、形状和字符,从而证明了在微流体设备尺寸范围内生成声学全息图的可能性。
原文链接:
https://doi.org/10.1002/smll.202307529











