微纳3D打印用于受生物启发瘤内输液口导管改善肝脏中的局部药物输送
发布日期:2024-11-27
浏览量:1125次
在癌症-免疫循环的多个环节中,通过向肿瘤组织内注射特定的免疫调节剂,可以有效实现肿瘤的免疫调节治疗。此种治疗方法的关键在于精准地干预免疫循环的各个阶段。目前,肿瘤内输液口导管技术在脑肿瘤治疗中已得到应用,然而,该技术并不适用于脑外肿瘤的治疗,因为在治疗过程中,由于呼吸运动的影响,输液口导管易发生移位,从而影响治疗效果的稳定性和安全性。因此,针对脑外肿瘤的治疗,需进一步研发适应性更强、稳定性更高的药物递送系统。
鉴于上述情况,来自希望之城国家医疗中心、瑞士南部成像研究所、伦德奎斯特研究所及加州大学洛杉矶分校医疗中心等国际知名研究机构的团队,运用摩方精密微立体面投影(PμSL)光刻3D打印技术,成功研制了一种新型带倒钩侧孔的输液口导管。该导管的设计灵感源自蜜蜂毒刺上的倒钩结构,旨在解决传统导管在肿瘤治疗中的定位问题。
该导管的倒钩设计能够确保其在肿瘤组织中的稳定性,防止因呼吸运动等因素导致的移位。侧孔的设计则旨在精确地将治疗药物输送至肿瘤组织,提高局部药物浓度。在猪肝脏的实验模型中,研究团队发现,使用该带倒钩侧孔的导管进行药物输送,能够实现比静脉注射高达183倍的局部药物浓度。
此外,高阻力侧孔与脉冲注射技术的结合,在导管内部形成了更高的压力,有效克服了组织阻力,从而显著提升了药物向肿瘤组织的输送效率。通过构建肿瘤内输液口导管的物理模型,研究团队准确预测了药物输送的结果,验证了该导管设计的有效性和实用性,并在肝脏中展现出了优异的固定性能,能够有效避免因呼吸运动引起的导管移位,并优先将药物输送至肿瘤组织,而非肿瘤内的血管,为肿瘤内输液治疗提供了更为精准和高效的解决方案。
相关研究成果以“Bioinspired intratumoral infusion port catheter improves local drug delivery in the liver”为题发表在期刊《Scientific Reports》上。
本研究中使用的带倒钩的侧孔输液口导管,是通过microArch® S240 微纳3D打印系统(精度:10 μm)制备而成,该技术在打印精度上远优于其他3D打印技术(图3)。研究团队之前尝试采用PolyJet和立体光刻技术,但均未能满足制造需求,主要原因是这些技术的分辨率不足以精确构建0.4 mm的侧孔。最终,团队利用摩方精密PμSL技术的高精度特性,成功实现了倒钩、侧孔以及中心通道的精确制造,解决了这一技术难题。
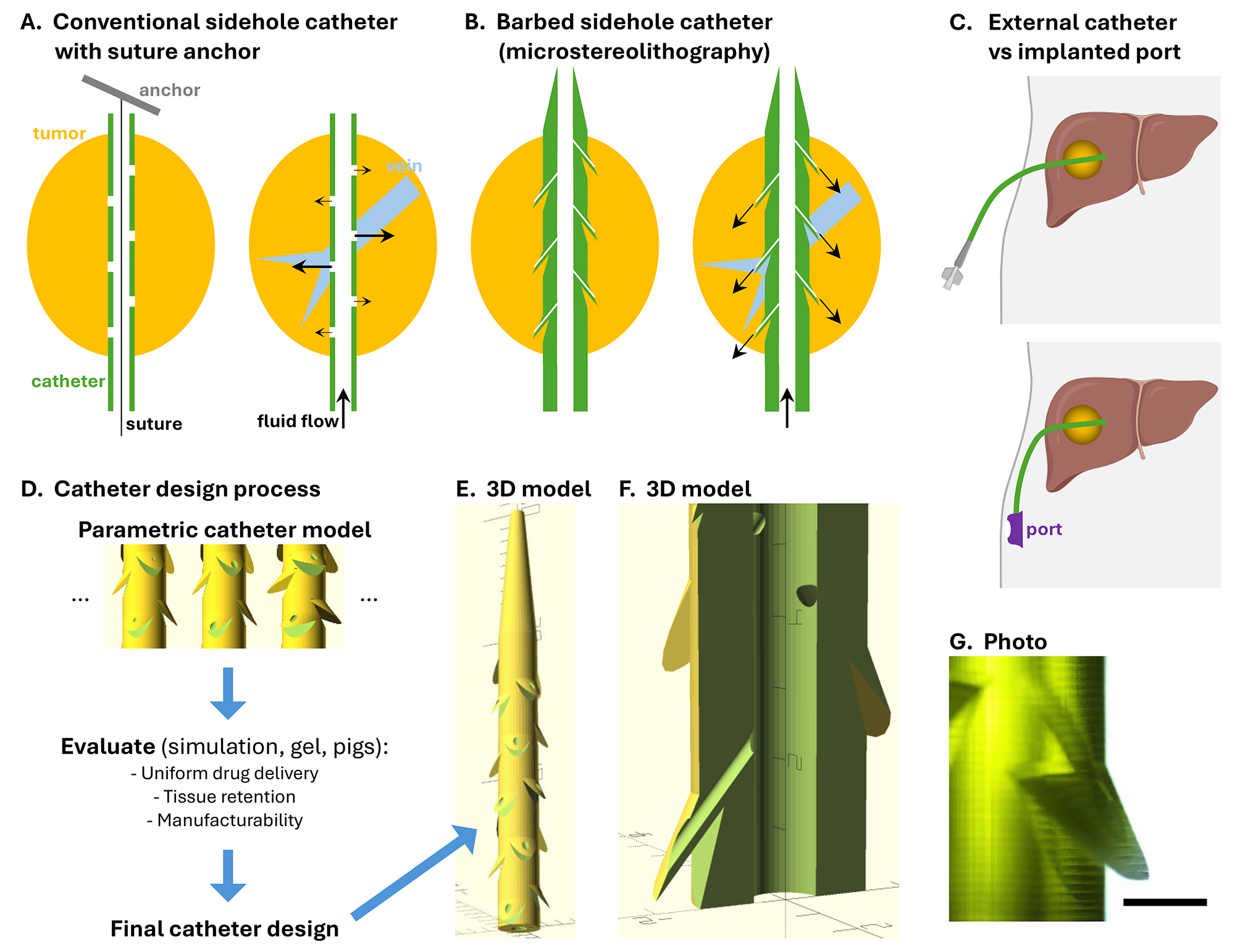
图1. 肿瘤内输液口导管设计。
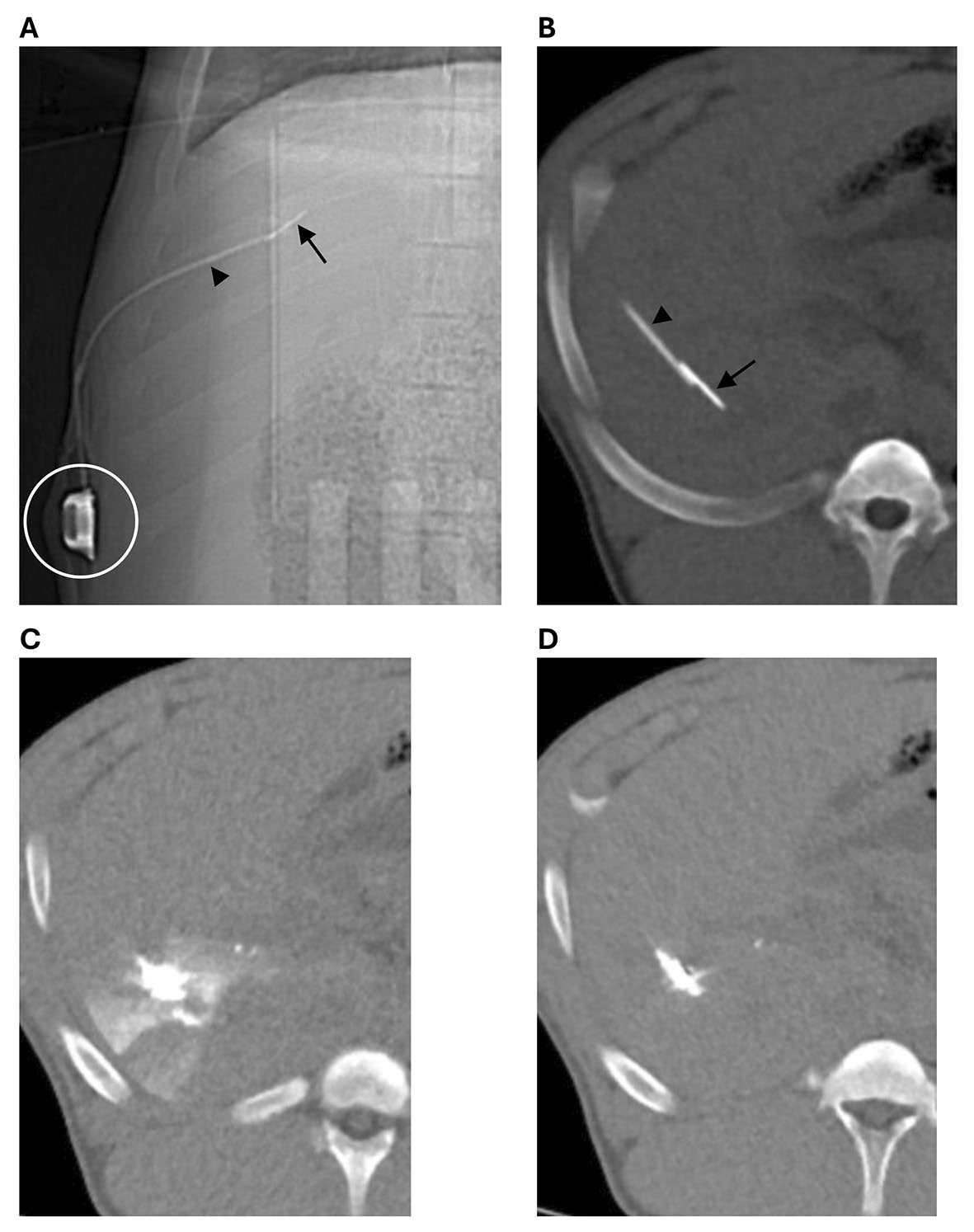 图2. 在猪体内的肝内输液口导管,连接到一个皮下端口(圆圈),使用缝合锚(箭头)将导管(箭头尖端)固定在肝脏中。肝脏中的金属锚附着在一根穿过导管的缝合线上,导管和缝合线都连接到端口上。
图2. 在猪体内的肝内输液口导管,连接到一个皮下端口(圆圈),使用缝合锚(箭头)将导管(箭头尖端)固定在肝脏中。肝脏中的金属锚附着在一根穿过导管的缝合线上,导管和缝合线都连接到端口上。
当在肝脏肿瘤中进行注射时,注射物质部分会留在肿瘤组织内,而另一部分则可能迅速进入肿瘤内的静脉系统。肿瘤内导管设计的核心目标在于最大化药物在肿瘤组织中的保留量。为在体外模拟并评估这一目标,团队采取了一种实验方法:将导管的侧孔一半嵌入凝胶中(模拟肿瘤组织),另一半嵌入生理盐水中(模拟肿瘤内静脉),随后进行染料注射,并测量凝胶与生理盐水中的染料含量。
实验结果显示,与传统侧孔导管相比,带有高阻力倒钩的侧孔导管在凝胶中实现了3.7倍的药物输送量(p=0.0098)。此外,与连续注射方式相比,采用脉冲注射方式在凝胶中实现了51倍的药物输送量(p=0.012)。这表明,脉冲注射在相同的平均流量率下,能够产生更高的峰值压力和流量率,从而更有效地将药物输送至肿瘤组织。其中,与静脉注射相比,使用带倒钩的侧孔导管的脉冲注射使每毫克碘海醇注射后的局部对比剂保留量提高了183倍,相关数据及分析见图4和图5。提高肿瘤内药物输送效率可通过增加侧孔阻力(采用较小的侧孔尺寸)或增加流量(实施脉冲流动)来实现。这些措施会导致导管内压力增加,从而克服组织压力,使得更多的药物能够被输送到肿瘤组织。
 图3. 带倒钩的侧孔导管。倒钩使导管固定在肿瘤中,而侧孔允许肿瘤内药物输液。
图3. 带倒钩的侧孔导管。倒钩使导管固定在肿瘤中,而侧孔允许肿瘤内药物输液。
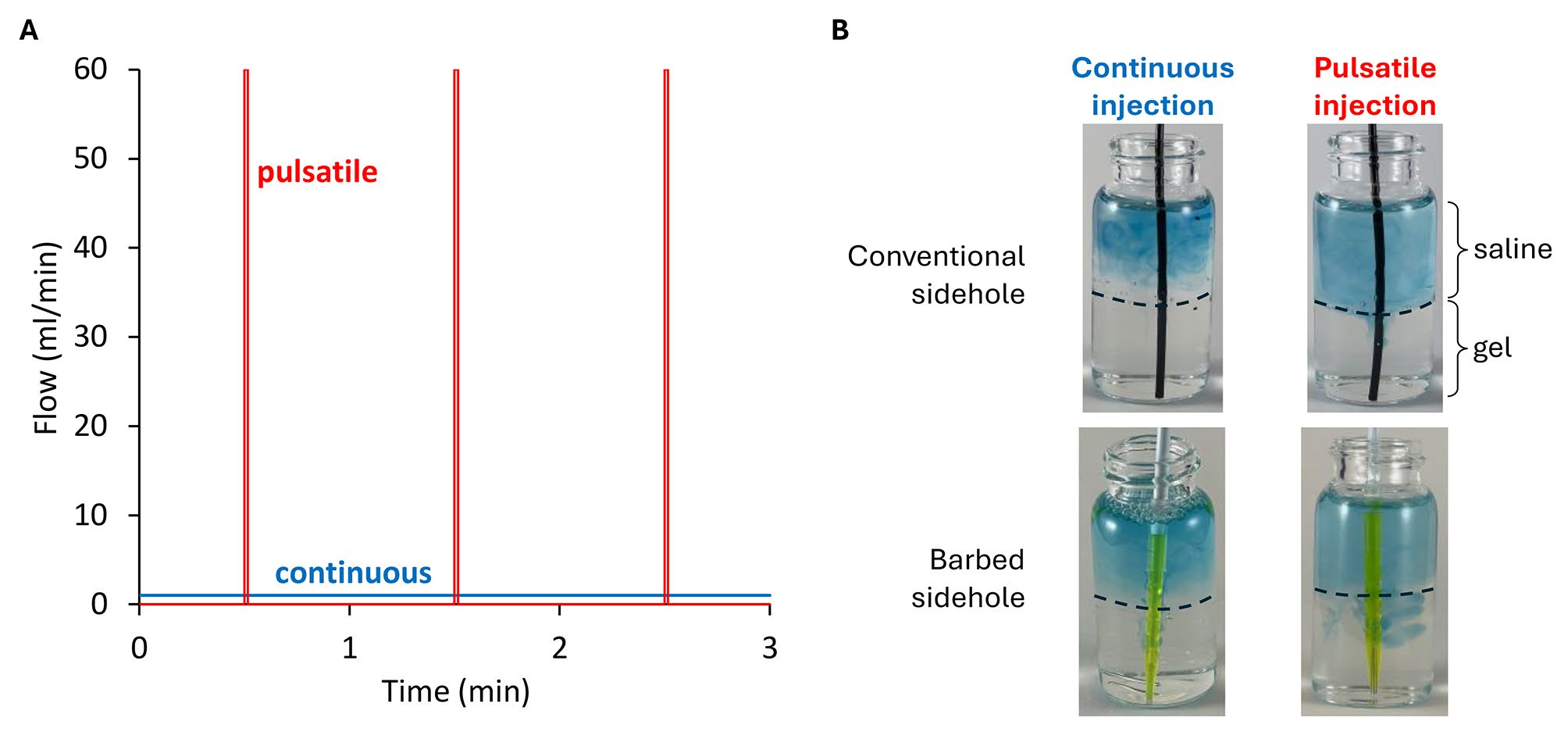 图4. 凝胶中的局部药物输送。
图4. 凝胶中的局部药物输送。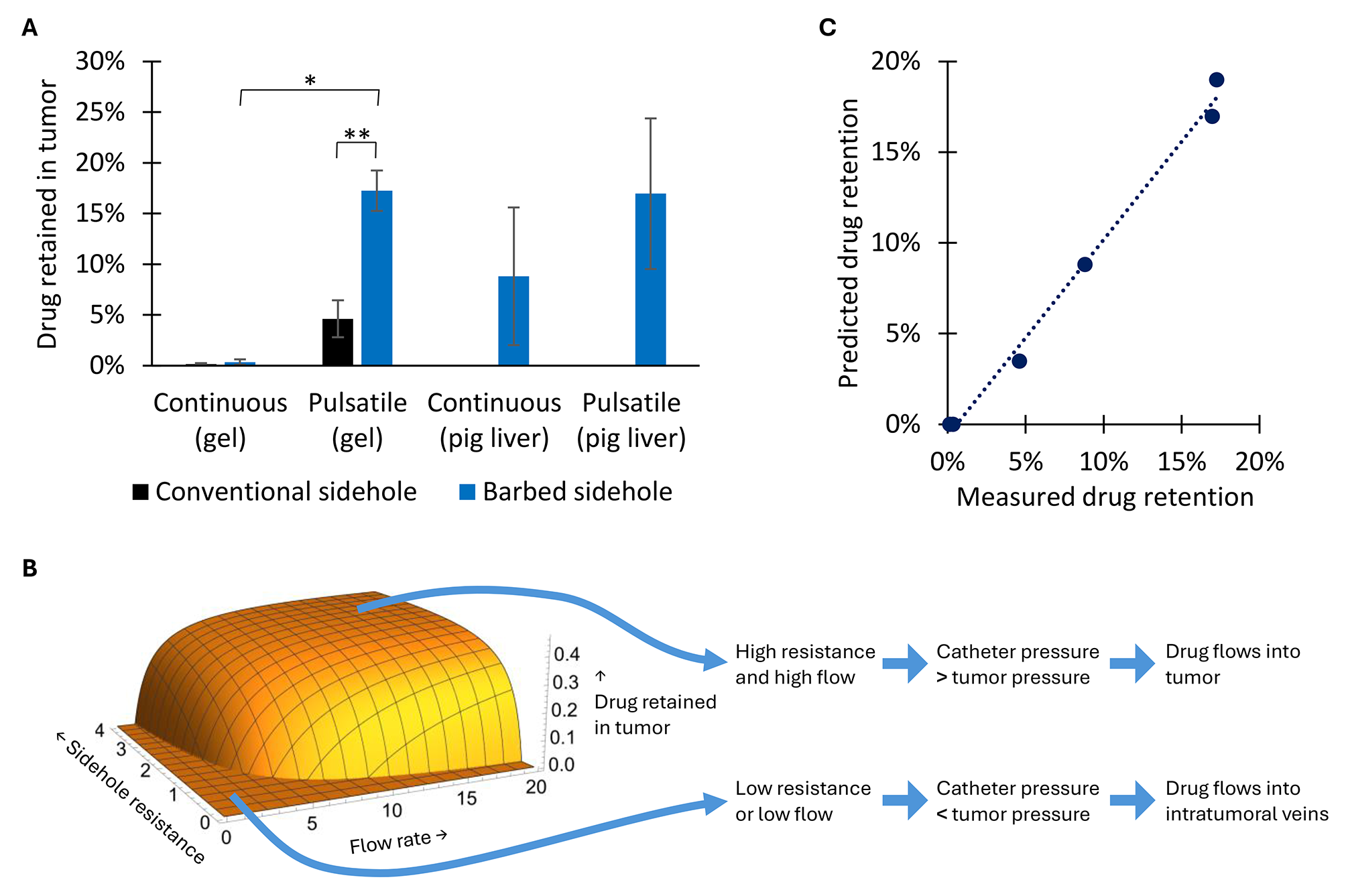 图5. 凝胶中和大猪体内的局部药物输送。
图5. 凝胶中和大猪体内的局部药物输送。总结:该研究团队设计了一种肿瘤内输液端口导管,它能够直接将免疫治疗剂输液到肿瘤中,且导管保留在肝脏中(不会随着呼吸运动移出),并且优先将药物输送到肿瘤组织中。
据该研究团队称,本项研究在学术界尚属首次报道了一种可与皮下端口连接的、可植入式肿瘤内输液口导管。未来的研究工作将着重于该导管的长期稳定性和性能评估,进一步优化固定机制和侧孔的几何设计,以及提升其可制造性,为最终进入人体试验阶段奠定基础。
原文链接:https://doi.org/10.1038/s41598-024-79694-4











