随着全球慢性炎症性肠病发病率逐年上升,溃疡性结肠炎(UC)已成为威胁人类健康的重要公共卫生问题。现有临床治疗方案普遍存在疗效波动与不良反应显著的局限性。天然药物大黄素虽展现出卓越的抗炎活性,但因其水溶性差、生物利用度低的特性,极大程度限制了临床转化进程。在纳米药物递送领域,脂质体作为理想的药物载体,具备提升药物递送效率与靶向性的显著优势。然而,传统脂质体制备技术面临流程繁琐、批次质量不均的瓶颈,新兴微流控技术亦因混合效率不足难以实现规模化应用。因此,开发创新性解决方案,实现纳米药物的精准制备与靶向治疗,已成为突破当前困境的关键方向。
近日,鲁东大学陈雪叶教授团队创新性地将微流控技术与机器学习深度融合,开发出“仿生叶脉沟槽—马蹄形”新型组合式微混合器(VGHM),结合NRBO-CNN-LSTM-Attention多元回归预测模型,实现了靶向大黄素脂质体(Apt-EMO@Lip)的精准可控制备,为溃疡性结肠炎的精准治疗提供了全新策略。
相关成果以“Machine learning-guided one-step fabrication of targeted emodin liposomes via novel micromixer for ulcerative colitis therapy”发表于“中国科技期刊卓越行动计划”领军期刊《Nano Research》上,2023级研究生陈鑫坤、潘玉丽为共同第一作者,陈雪叶教授与鲍诚副教授为通讯作者。
(1)本研究将植物叶脉的凹槽结构与马蹄形流体分汇原理结合起来,设计了一种新型的仿生叶脉-马蹄形耦合微混合器(VGHM),具体的设计结构如图1a所示。通过摩方精密面投影微立体光刻(PμSL)3D打印技术(nanoArch® P150,精度:25μm)制造模具,结合PDMS模塑与等离子键合工艺制备出完整器件,其微通道形貌和封装结构如图1b-e所示。
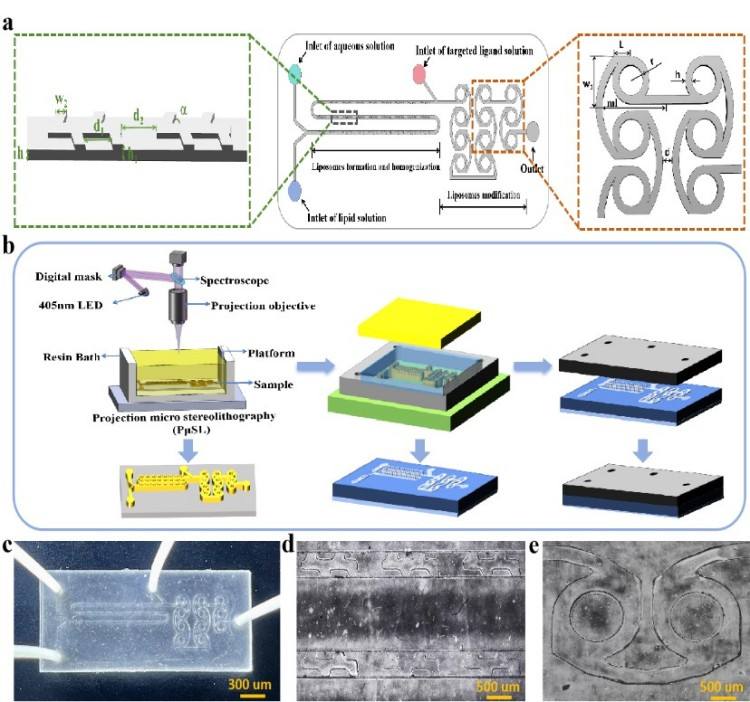
图1. 微混合器设计图。(a)微混合器详细信息(尺寸、组成、入口);(b)制备流程图;(c)微混合器实物图;(d、e)微通道超景深显微镜图。
(2)通过COMSOL数值模拟构建流体动力学模型,结合双染料溶液实验验证混合机制,具体的流场质量分数云图与流线分布如图2a-b所示。实验装置采用高速摄像机记录微通道内混合过程(图2d),实验结果与模拟结果对比显示趋势一致(图2f-g)。
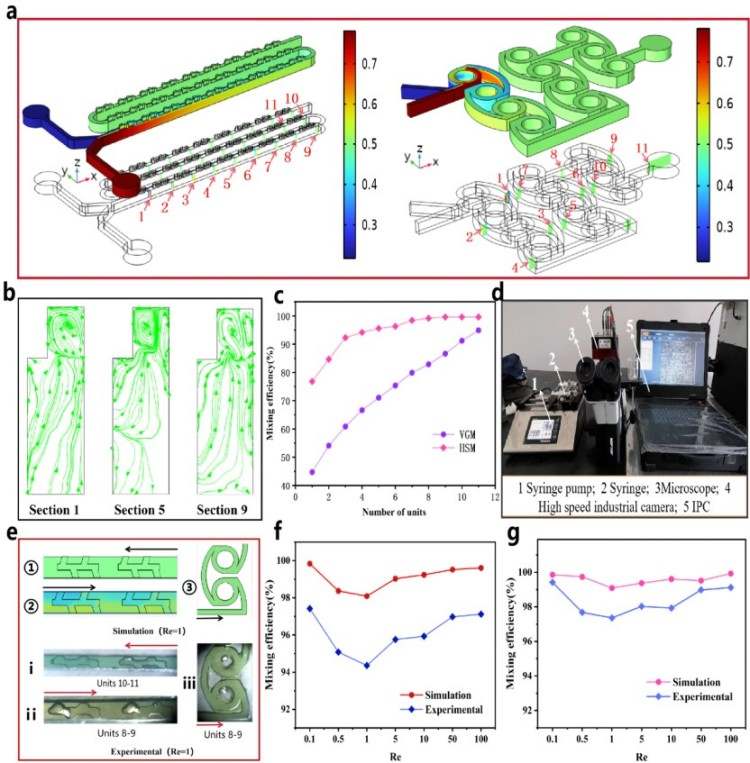
图2. 微混合器性能评估。(a)仿真质量云图;(b)VGM不同截面的流线分布;(c)两种结构不同混合单元数下的混合效率;(d)实验装置;(e)局部实验图对比仿真图;(f、g) 数值模拟与实验数据对比。
(3)本研究使用VGHM一步合成Apt-EMO@Lip策略,将脂质分子有机相与缓冲液水相在微通道内动态混合,驱动脂质体从条状→盘状→球形进行演变,并通过HSM单元实现适配体共价偶联。
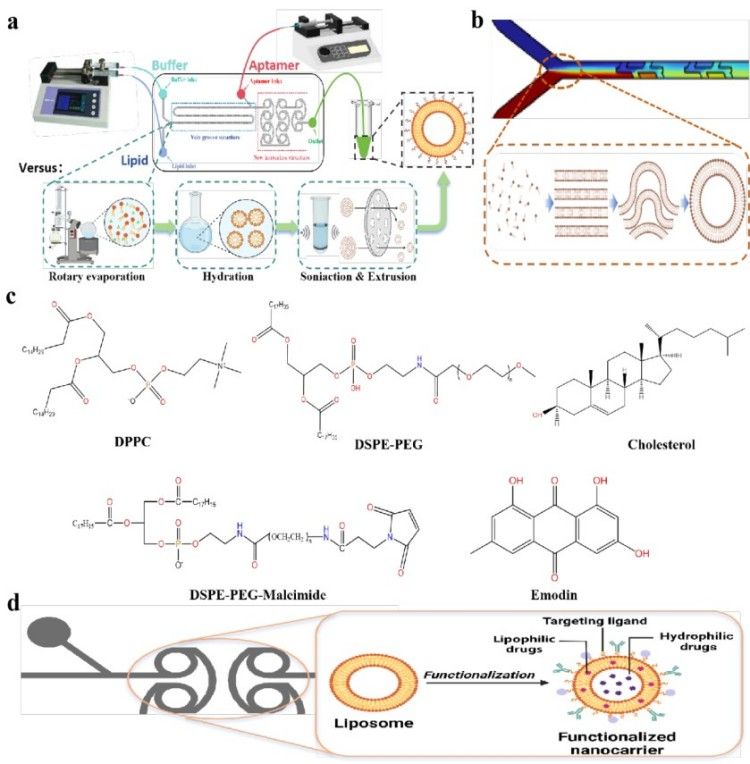
图3. 一步形成靶向脂质体机制。(a)VGHM与薄膜水合法制备靶向脂质体的对比示意图;(b)VGM中脂质体的自组装形成过程;(c)脂质体成分的化学结构;(d)靶向脂质体形成的机制。
(4)通过系统探究微流控制备变量,将流速比(FRR)、总流速(TFR)及溶剂类型作为关键参数。实验结果证实FRR=40:1时粒径最小,乙醇溶剂优于甲醇/氯仿;所得Apt-EMO@Lip呈单峰分布、电位-45.54mV,4℃储存4周稳定性良好,TEM显示典型球形形貌。
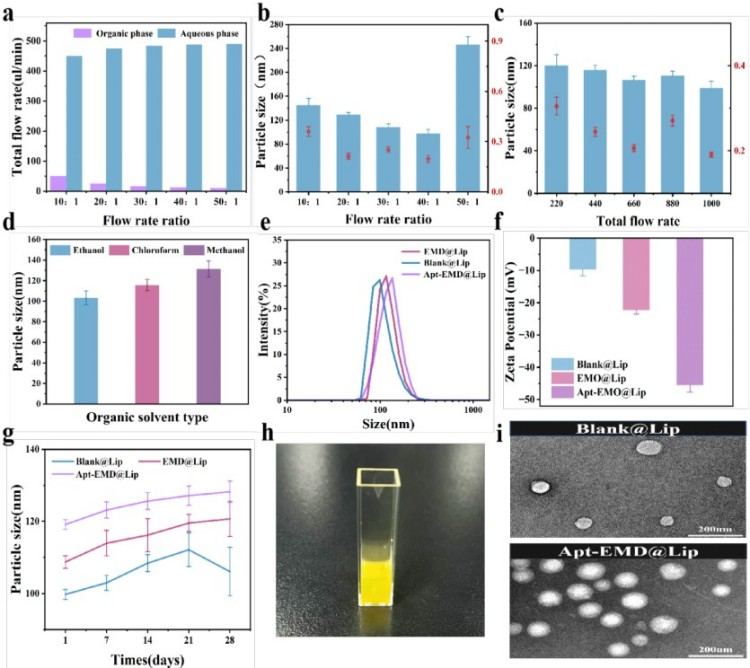
图4. 制备参数对脂质体的特性影响图。(a)流量信息配置;(b)FRR对粒径和PDI的影响。(c)TFR对粒径和PDI的影响;(d)溶剂类型对粒径的影响;(e)Blank@Lip、EMO@Lip和Apt-EMO@Lip的粒径分布;(f)Blank@Lip、EMO@Lip和Apt-EMO@Lip的Zeta电位值;(g)Blank@Lip、EMO@Lip和Apt-EMO@Lip在4℃储存条件下的长期稳定性;(h)纯化的Apt-EMO@Lip样品图;(i)TEM图像显示Blank@Lip和Apt-EMO@Lip的球形形态(标尺=200 nm)。
(5)通过创新性融合牛顿-拉夫逊优化(NRBO)、卷积神经网络(CNN)、长短期记忆网络(LSTM)及注意力机制,构建多变量回归预测模型用于预测不同条件下脂质体粒径尺寸。模型对脂质体粒径预测精度达R²=0.9574(RMSE=6.52nm)。
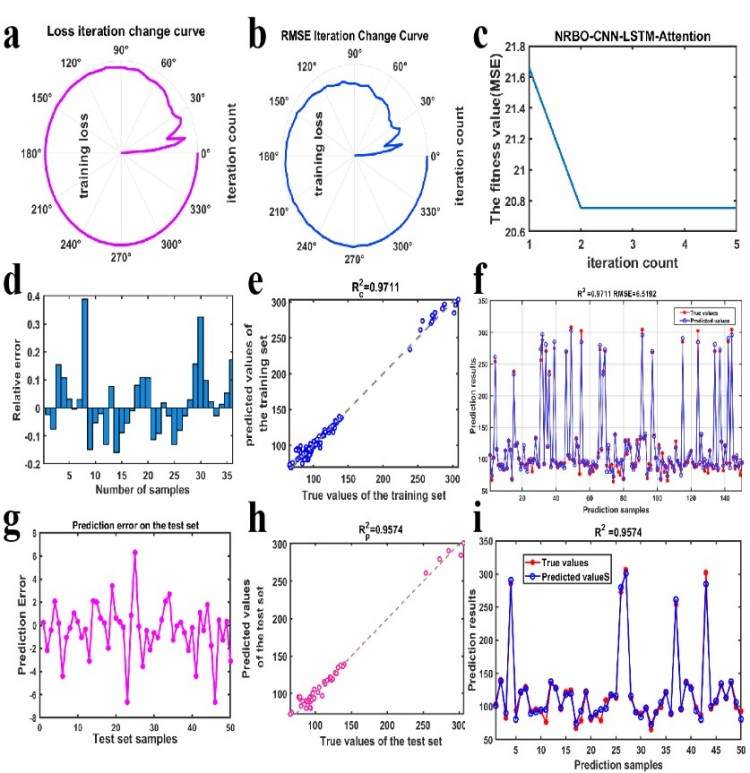
图5. 机器学习预测粒径图。(a)训练损失随迭代次数变化图; (b)均方根误差(RMSE)随迭代次数变化图;(c)模型训练适应度曲线;(c)相对误差图;(d)训练集样本拟合度;(f)训练集预测值与真实值对比;(g)测试集样本的预测误差分布;(h)测试集样本拟合度;(i)测试集预测值与真实值对比。
(6)通过对比分析两种技术路径,将微流控法(MF-EMO@Lip)与薄膜水合法(TFH-EMO@Lip)的理化特性并置评估。涵盖粒径分布、形态、稳定性、电位及细胞毒性等关键指标,为制备方法选择提供依据。
(7)通过体外模拟胃肠道环境评估药物释放行为,展现出了良好的缓释特性(48h释放率58.62%)。我们进一步通过RAW264.7巨噬细胞模型评估脂质体的抗炎活性,Elisa实验结果显示,经EMO@Lip处理后,促炎因子NO、TNF-α、IL-6和IL-1β的水平显著降低;Caco-2细胞划痕实验证实其加速肠道屏障细胞层损伤修复。
总结:本研究通过“微流控技术-机器学习” 的协同创新,构建了一步法制备靶向脂质体的高效策略,突破了传统脂质体制备的效率与一致性瓶颈,结合智能预测模型实现了粒径的精准调控,在溃疡性结肠炎的体外模型中展现出优异的抗炎与肠屏障修复能力。该成果为中药活性成分的精准递送及炎症性疾病的靶向治疗开辟了新路径。
原文链接:https://doi.org/10.26599/NR.2025.94907713