腔内支架植入是治疗胆道狭窄等梗阻性病变的常用介入手段,然而,传统输送系统因器械刚度高、操作自由度低,难以在远端曲折的管道中安全穿行,易在肝内胆管等远端狭窄部位引发穿孔、支架误置等风险。近年来,磁控微机器人凭借其微创、可远程操控和穿透深部组织的优势,为腔内精准介入提供了全新思路。然而,受制于微型尺度下的“尺寸-力量权衡”,如何在保持灵活性的同时赋予其强大的扩张能力,是推动该技术走向临床必须解决的难题。
针对上述难题,香港中文大学张立教授团队在《Science Advances》上发表了题为“Modular magnetic microrobot system for robust endoluminal navigation and high–radial force stent delivery in complex ductal anatomy”的研究论文,提出了一种模块化磁控微机器人系统。文章第一作者是香港中文大学博士后苏琳,文章通讯作者是香港中文大学张立教授和陈启枫研究助理教授。
该系统创新性地将磁驱动模块与超声响应型自膨胀支架模块相结合,通过旋转方向控制实现“集成推进”与“定点分离”两种状态的智能切换,并利用聚焦超声触发支架在病灶处的快速膨胀,实现了在复杂管道内的稳定穿行与支架的按需精准部署(图1)。
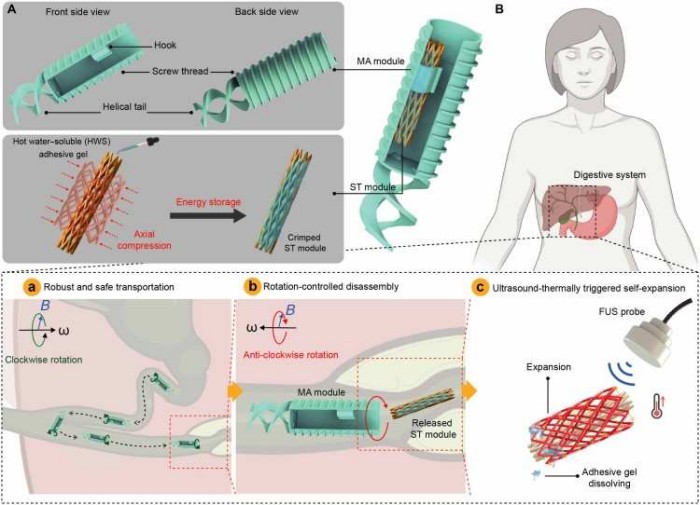
图表1. 用于胆道支架植入的模块化微机器人系统示意图。(A) 系统组成:磁驱动模块与可膨胀支架模块集成。(B) 在胆道系统中的支架植入流程:(a) 顺时针旋转磁场下导航;(b) 到达病灶后逆时针旋转解离;(c) 超声触发支架原位扩张。
为此,作者团队分别合成了两种水凝胶打印树脂,并采用摩方精密面投影微立体光刻(PµSL)技术(nanoArch® S130,精度:2μm)制备了两种模块。磁驱动模块的打印树脂由聚乙二醇二丙烯酸酯(PEGDA)、交联剂DPHA、增稠剂PVP及NdFeB@SiO₂磁性颗粒组成,赋予模块高磁响应性与结构精度(图2)。支架模块则采用含钽微粒的韧性水凝胶材料打印而成,不仅具备良好的生物相容性,还可作为超声成像对比剂,其径向刚度达0.516 N/cm,满足临床胆道与血管的支撑需求(图3)。
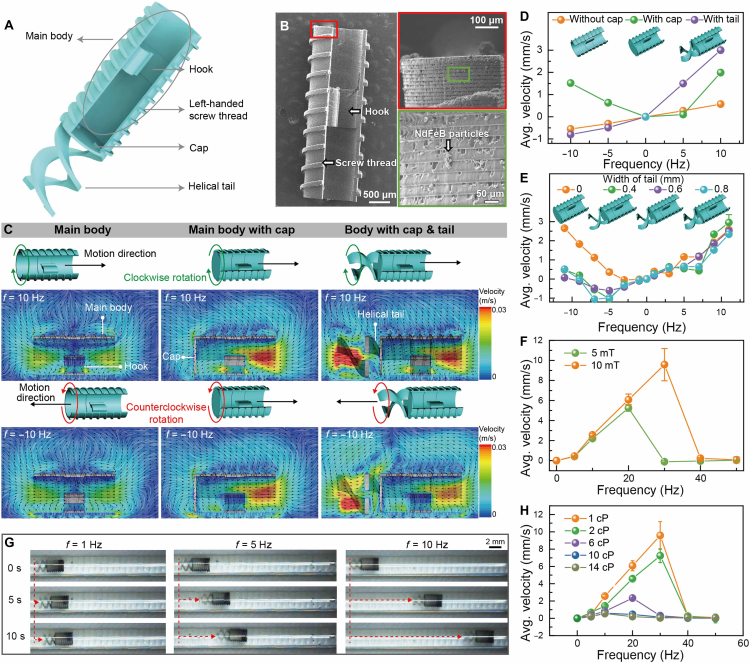
图表2. 磁驱动模块的设计与性能表征。(A) 模块结构示意图,包含主体、左旋螺纹、盖帽和螺旋尾翼。(B) 3D打印模块的SEM图像。(C) 不同结构在顺时针/逆时针旋转下的模拟流线图。(D) 模块平均推进速度与旋转频率的关系。(E) 螺旋尾翼宽度对推进速度的影响。(F) 不同磁场强度下的速度-频率曲线。(G) 不同频率驱动下的运动图像。(H) 不同流体粘度环境中的运动性能。
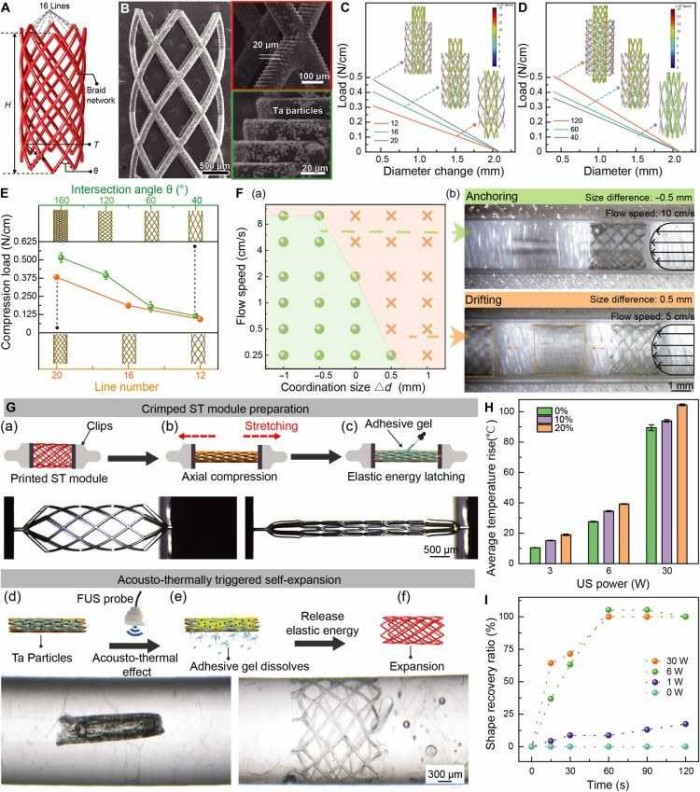
图表3. 支架模块的设计与功能表征。(A) 支架模块结构示意图,显示编织线数、角度等参数。(B) 打印支架的SEM图像。(C, D) 模拟显示线数与编织角对径向压缩性能的影响。(E) 不同几何参数下压缩至50%直径所需载荷。(F) 支架在不同配合尺寸(Δd)下的锚定性能。(G) 支架压缩固定与超声触发扩张过程示意图。(H) 不同钽颗粒浓度下超声功率与温升关系。(I) 不同超声功率下支架形状恢复率随时间变化。
该系统的核心创新在于其“旋转控制组装策略”(图4)。磁驱动模块内部设计了基于阿基米德螺旋线的锁钩结构,当模块顺时针旋转时,支架模块被牢牢约束在腔内,实现稳定输送;一旦抵达目标位置,逆时针旋转即可在离心力作用下于3秒内完成精准释放。这一机制有效解决了传统磁控机器人在导航过程中易丢失负载、难以在狭窄空间内可控释放的难题。
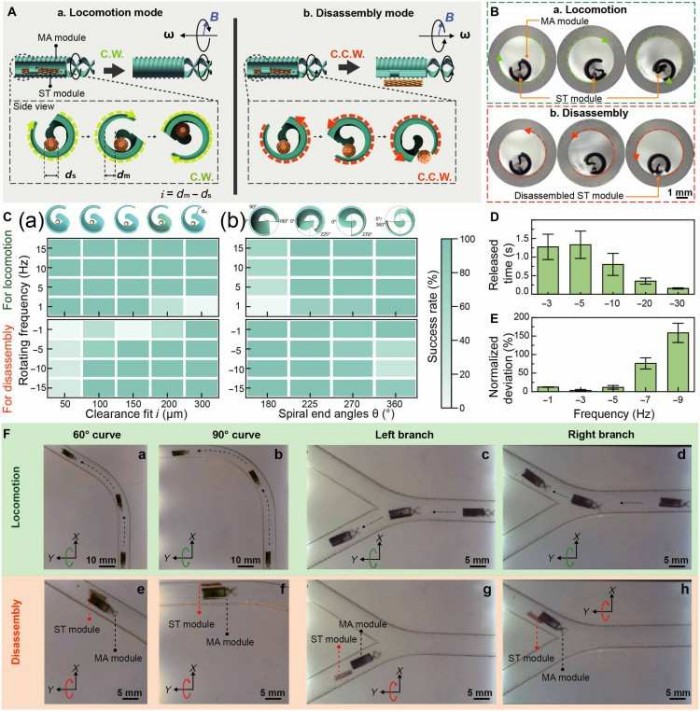
图表4. 模块化机器人的组装与解组装性能。(A) 运动模式与解组装模式示意图。(B) 两种模式的实验图像。(C) 间隙配合与螺旋末端角度对组装/解组装成功率的影响。(D) 旋转频率对解组装时间的影响。(E) 旋转频率对投放精度的影响。(F) 机器人在不同地形(弯道、分叉)中的运动与解组装实验。
研究团队在多层分支胆道模型及离体猪胆管中成功验证了该系统的全流程操作:微机器人可在超声引导下沿3.5 cm路径精准导航,在目标位置3秒内完成支架释放,并于30秒内通过超声热触发实现完全膨胀,将管腔直径扩大约2.5倍。该系统兼具微创性、高精度与临床兼容性,为未来深部腔内介入治疗提供了全新的技术平台。综上,这项工作有力地促进了生物医用多功能微型机器人的发展,为其今后走向实际应用提供重要参考。
原文链接:https://doi.org/10.1126/sciadv.ady4339